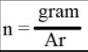2. Persamaan Reaksi Kimia
3. Jumlah Produk dan Reaktan
4. Penyetaraan Reaksi Kimia
5. Hasil Reaksi
6. Link Download
3.6 Menentukan Rumus Empiris Berdasarkan Hasil Percobaan
[kembali]
Rumus empiris adalah rumus yang berisikan data banyaknya unsur pembentuk yang berada pada suatu senyawa. Contohnya senyawa gas metana ( CH4 ) memiliki arti bahwa dalam satu mol gas metana berisi satu atom karbon dan empat atom hidrogen.Sebagai contoh kita akan menentukan rumus empiris dari 11,5 g etanol akan dibakar dalam suatu Apparatus yang terlihat dalam gambar dibawah ini.
Setelah itu kita misalkan percobaan tersebut menghasilkan 22,0 g CO2 dan 13,5 H2O. Berdasarkan itu kita dapat mencari massa Karbon dan Hidrogen dari etanol
Untuk menghitung massa dari oksiken kita hanya perlu menggurangkan massa etanol dengan massa karbon dan hidrogen.
massa O = massa Etanol - ( massa C + massa H )
= 11,5 g - ( 6 g + 1.51 g )
= 4 g
Setelah mencari semua massa unsur penyusun etanol, kita harus mencari jumlah mol nya. Jumlah mol tersebut akan kita gunakan sebagai rumus empiris.
n= mol Ar = massa atom relatif
gram= massa unsur
Maka dapatlah rumus empiris untuk senyawa etanol C0.5H1.5O0.25. Karena penulisan atom harus dalam bilangan bulat kita harus membagikan angka dalam rumus empiris tersebut dengan angka terkecilnya ( 0,25) . Setelah itu Jadilah rumus empiris unutk senyawa etanol yaitu C2H6O.
RUMUS MOLEKUL
Rumus molekul adalah rumus yang berupa kelipatan dari rumus empiris suatu senyawa. Rumus molekul menunjukkan banyak sebenarnya dari suatu senyawa.
Contoh Soal
suatu senyawa memiliki atom N sebanyak 30,46% dan 69.54% . Senyawa tersebut memiliki berat kisaran 90g 一 95g tentukan rumus molekulnya...
Pembahasan
1) Mencari massa dari rumus empiris senyawa
2) Bandingkan massa kisaran senyawa dengan massa dari rumus empiris
Penyelesaian
1)
Untuk mencari massa dari rumus empiris, carilah rumus epiris senyawa tesebut dengan mengganggap berat senyawa tersebut 100
Maka dapatlah rumus empiris dan sederhanakan lah tersebut
N2,174O4,346 = NO2
Setelah itu carilah massa nya dengan menggalikan jumlah atom dan
massa relatif setiap unsur nya kemudian di jumlahkan
m senyawa = 14,01*1 + 16,00*2 = 46,1 g

2)
bandingkan massa empirisnya dengan massa perkiraaan nya
90 g / 46,1 g ≈ 2
adalah NO2 atau N2O4
3.7 Reaksi Kimia dan Persamaannya
[kembali]
Reaksi kimia adalah suatu proses perubahan zat kima yang akan menghasilkan zat kimia baru.Sedangkan persamaan reaksi kimia adalah gambaran tertulis mengenai proses perubahan zat kimia tersebut.Contohnya pada reaksi gas hidrogen dan gas oksigen sebagai berikut.
2H2 + O2 ➝ 2H2O
tanda ( + ) menandakan suatu zat direaksikan dengan zat lainnya dan tanda ( ➝ ) artinya menghasilkan . selain itu pada persamaan kimia bagian kiri tanda ( ➝ ) dapat ditandai sebagai reaktan artinya zat yang dicampur dan bagian kanan disebut produk yaitu hasil dari pereaksian.Sebagai pelengkap pada persamaan reaksi kimia juga dapat ditambahkan sifat suatu zat yaitu padatan (s), cair (l), gas (g), dan larutan (aq).
3.8 Penyetaraan Reaksi Kimia
[kembali]
Suatu persamaan kimia ditulis dengan syarat setara artinya atom pada unsur yang ada di kiri tanda panah haruslah sama dengan yang ada di kanan. Adapun caranya sebagai berikut:
- Cobalah menambahkan koefisien unsur untuk melakukan penyetaraan, namun kita tidak dapat mengganti angka kecil yang berada disebelah kanan unsur karena itu akan mengubah arti unsur tersebut.
- Untuk mempermudah penyetaraan, kita ubah terlebih dahulu unsur yang hanya muncul sekali dan memiliki jumlah yang tidak sama, ketika melakukan hal tersebut mungkin akan ada perubahan pada unusr yang sudah setara pada persamaan kita hanya harus melakukan penyesuaian.
- Setelah itu hitung kembali jumlah setiap unsur pada persmaan apakah sudah setara atau belum.
contoh:
KClO3➝KCl + O2
Pada persamaan di atas Oksigen memiliki nilai yang berbeda , unutk itu kita perlu melakukan penyetaraan dengan cara mengganti koefisien oksigen kedua ruas
2KClO3➝KCl + 3O2
Setelah itu kita setarakan kembali nilai dari KCl dengan mengubah koefisien yang berada pada sebelah kanan karena jika kita mengubah koefisien KCl yang berada di kiri akan menyebabkan nilai Oksigen yang berda di kanan ikut berubah
2KClO3➝2KCl + 3O2
Cek kembali nilai unsur yang berada di ruas kanan dan kiri jika sudah sama, persamaan sudah setara.
3.9 Jumlah Produk dan Reaktan
[kembali]

Pertanyaan awam yang selalu ada saat uji coba di lab kimia adalah mengenai banyak nya jumlah zat yang dihasilkan dari suatu reaksi kimia. Untuk menjawab pertanyaan tersebut kita perlu mempelajari stoikiometri, ilmu ini mempelajari mengenai kuantitas suatu reaktan dan produk pada reaksi kimia.
Untuk mengetahui berat ataupun volume suatu produk, kita harus melakukan metode mol,secara sederhana koefisien stoikiometri pada persamaan kimia dapat mewakilkan jumlah mol pada setiap unsur contohnya pada membuatan amonia dibawah ini.

Sekarang seandainya kita memiliki 16,0 g H2 yang direaksikan dengan N2 membentuk NH3, pertanyaan nya berapakah berat dari NH3 ?
Pertama kita ubah massa H2 Kebentuk molnya menggunakan massa atom relatif.
Lalu kita cari jumlah mol dari NH3.
Terakhir ubah mol NH3 ke bentuk massa denggan mengkunakan massa atom relatifnya.
Reaksi pembatas menentukan banyak nya produk yang dihasilkan dari suatu reaksi, hasil yang di hitung dari rekasi pembatas disebut hasil teoritis, kenapa ? karena banyak hasil asli dari suatu reaksi kimia lebih sebihik dibandingkan dengan hasil teoritis nya yang dihitung berdasarkan rekasi pembatas. hal seperti dapat terjadi karena beberapa reaksi bersifat reversibel artinya reaksi terjadi 100% selain itu terdapat unsur yang bereaksi kepada dirinya sendiri sehingga mempengaruhi produk.
Untuk mengetahui seberapa efisien suatu reaksi gunakan rumus berikut ini.
Ke efisienan suatu reaksi berkisar dari 0% 一 100%. Berikut adalah Contohnya:
Pada suatu pabrik sebanyak 3,54*10^7 TiCl4 direaksikan dengan 1,13*10^7 g Mg. carilah hasil teoritis dan hitunglah berapa persen hasil jika hasil asli dari Ti sebesar 7,91*10^7.
A. Untuk mencari hasil teoritas ikuti langka dibawah ini:
1. Carilah hasil mol dari Ti menggunakan kedua reaktan.
2. reaktan yang menghasilakn nilai mol terkecil adalah pereaksi pembatas.
gunakan hasil tersebut unutk mencari berat dari Ti.
Pembahasan
1. - Hasil dari TiCl4 :
- Hasil dari 2Mg:
2. Berdasarkan operasi diatas guanakan hasil pertama yaitu
sebesar 1,87*10 mol Ti untuk mencari beratnya.
B. Untuk mencari persenan hasil ikuti rumus yang telah dituliskan di atas.
Dapat disimpulkan bahwa reaksi tersebut kurang dari 100%

 3.10 Hasil Reaksi
[kembali]
3.10 Hasil Reaksi
[kembali]