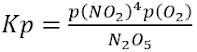L&K 5
LATIHAN
Example 14.1
Tuliskan Kc dan Kp dari dekomposisi dinitrogen pentoksida
Jawab:
Example 14.3
Konstanta kesetimbangan KP untuk reaksi
adalah 158 pada 1000 K. Hitung PO2 jika PNO2 = 0,400 atm dan PNO = 0,270 atm.Jawab:
PO2 = 158 x (0,4)^2 / 0.27^2
= 346,78
N₂ (g) + H₂ (g) ---> NH₃ (g)
adalah 1,2 pada suhu ini, tentukan apakah sistem berada pada kesetimbangan. Jika tidak, memprediksi arah reaksi bersih akan berlanjut.

Example 14.8
Pada awal reaksi, diperoleh 0,249 mol N2 , 3.21x 10^-2 mol H2. , dan 6.42 x 10^-4 mol NH 3.dalam bejana reaksi 3,50-L pada 375 ° C. Jika kesetimbangan konstan (Kc) untuk reaksinyaN₂ (g) + H₂ (g) ---> NH₃ (g)
adalah 1,2 pada suhu ini, tentukan apakah sistem berada pada kesetimbangan. Jika tidak, memprediksi arah reaksi bersih akan berlanjut.

KUIS
Problem 14.14
Reaksi dibawah ini menggambarkan bentuk setimbang dari reaksi berbeda dari tipe
A+X ⇌ AX (X=B,C, atau D)
Reaksi mana yang memiliki Konstanta ekuibrilium terbesar ? dan yang terkecil ?Jawab:
Konstanta ekuibrilium (Kc) memiliki rumus besar [Produk] : [Reaktan] sehingga semakin banyak produk semakin besar Kc. Maka Kc terbesar adalah reaksi kedua (A+C ⇌ AC) dan yang terkecil adalah reaksi ketiga (A+D ⇌ AD)
Problem 14.15
Kc pada reaksi
2HCl(g) ⇌ H2(g) + Cl2(g)
adalah 4,17x 10^-34 pada suhu 25 C. berapa Kc pada reaksi
H2(g) + Cl2(g) ⇌ 2HCl(g)
Kc = [Produk] / [Reaktan]
= 1 / 4,17x 10^-34
= 0,24 x 10^34
= 1 / 4,17x 10^-34
= 0,24 x 10^34
Problem 14.40
.N₂ (g) + 3H₂ (g) ---> 2NH₃ (g)konstanta kesetimbangan Kc pada 375 ° C adalah 1,2. Memulai dengan [H2] = 0,76 M, [N2] = 0,60 M, dan [NH3] = 0,48 M, dimana gas akan mengalami peningkatan konsentrasi dan yang akan memiliki penurunan konsentrasi kapan campuran mencapai kesetimbangan?.
Jawab:
Gas mengalami peningkatan,penurunan konsentrasi dan mencapai kesetimbangan pada saat terbentuknya NH3